Per Sehar Tariq, 2n BTX
Introducció
Avui dia, gràcies als avenços tecnològics en el camp de biotecnologia, hi ha hagut un progrés molt ràpid i fa pocs anys els científics van descobrir la seqüència completa del genoma humà. En el últims anys hi ha hagut descobriments sobre tècniques d’edició genètica i aquests avenços han portat molts beneficis a la nostra societat, ja que s’utilitzen per la creació de vacunes, la reparació genètica, o per crear resistència a malalties en humans, animals o plantes. La biotecnologia ens permetrà posar remei a problemes de la salut humana i de la indústria que, actualment, som incapaços de resoldre. Fa molt poc ha sorgit una altra tècnica d’edició genètica, el CRISPR-CAS9, que d’aquí uns anys podria accelerar el descobriment de solucions a moltes malalties genètiques.
L’elecció del tema d’aquest treball va ser una mica difícil, tenia clar que l’àmbit seria les ciències de la salut però no sabia què triar. La meva tutora, Dunia Aparicio, em va oferir la possibilitat de fer-lo a la Facultat de Medicina de l’Hospital de Bellvitge amb el professor Joan Blasi.
A finals del mes de gener vaig tenir la primera reunió amb ell i em va explicar una mica el que ells estaven fent en el seu laboratori. Un dels temes que estaven estudiant era el CRISPR-CAS9, el tema em va cridar l’atenció i vaig decidir que el meu treball tractaria de les tècniques d’edició genètica i el CRISPR-CAS9.
En la meva segona trobada amb el professor de laboratori vam concretar que faria una pràctica de transfecció cel·lular per trobar si l’acceptor de la toxina Èpsilon és la proteïna MAL (Myelin And Lymphocyte protein), proteïna integral de membrana que si s’unís amb la toxina Èpsilon pot matar a la cèl·lula i per tant provocar danys a l’individu. Aquesta toxina es troba en l’intestí dels animals remugadors i si s’ajunta amb la proteïna podria matar les cèl·lules. El MAL, entre d’altres llocs, també es troba en la mielina (capa que recobreix les neurones), de manera que si el receptor de la toxina és el MAL, la toxina podria ser un desencadenant de l’atac autoimmunitari al sistema nerviós dels malalts d’esclerosi múltiple.
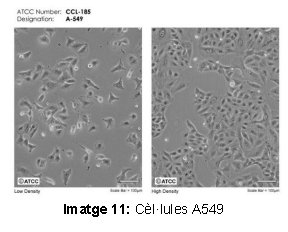 Aquesta pràctica la faríem amb dos tipus de cèl·lules diferents, les JEKO-1, limfòcits B, i les A549, cèl·lules epitelials del pulmó. Amb aquesta experimentació posaríem en pràctica dues tècniques d’edició genètica, ja que la pràctica del CRISPR era molt més llarga i complexa i no es podia dur a terme amb el temps del que jo disposava. De manera que vam haver de reconduir una mica el camí per on aniria el treball.
Aquesta pràctica la faríem amb dos tipus de cèl·lules diferents, les JEKO-1, limfòcits B, i les A549, cèl·lules epitelials del pulmó. Amb aquesta experimentació posaríem en pràctica dues tècniques d’edició genètica, ja que la pràctica del CRISPR era molt més llarga i complexa i no es podia dur a terme amb el temps del que jo disposava. De manera que vam haver de reconduir una mica el camí per on aniria el treball.
El treball es basa en una anàlisi de les tècniques d’edició genètica actuals i la seva comparació amb el CRISPR-CAS9. La pregunta que em vaig fer va ser la següent:
- Quins avantatges aportarà la tècnica CRISPR-CAS9 en el futur en comparació amb les tècniques d’edició genètica actuals?
A partir d’aquesta pregunta els objectius principals que em vaig plantejar són:
- Saber quins són els avantatges i inconvenients del CRISPR-CAS9, la nova tècnica, sobre els mètodes de transfecció que s’utilitzen actualment.
- Saber quins problemes ètics pot provocar l’ús de la nova tècnica CRISPR-CAS9.
Referent a la pràctica al laboratori em vaig proposar altres objectius: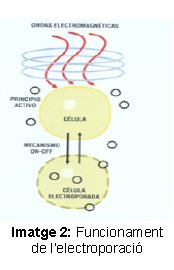
- Fer una transfecció cel·lular mitjançant el mètode de la Lipofectamina i l’Electroporació.
- Saber si la proteïna MAL reconeix la toxina Èpsilon en les cèl·lules JEKO-1 (limfòcits B) i en les cèl·lules A549.
Aleshores, tenint en compte els objectius vaig fer les següents hipòtesis:
- El CRISPR-CAS9, al futur, suposarà un gran canvi en l’edició genètica ja que té molts avantatges sobre les tècniques actuals perquè es podran editar genèticament éssers amb més facilitat i més rapidesa.
- Un gran nombre de cèl·lules incorporaran el gen de la proteïna MAL i l’expressaran.
- La proteïna MAL reconeixerà la toxina Èpsilon en les cèl·lules JEKO-1 i en les cèl·lules A549.
Per poder aconseguir dades i informació vaig anar a la Universitat de Barcelona, Campus Bellvitge, per treballar al laboratori 4145 que és el departament de patologia i terapèutica experimental/ unitat d’histologia. A més a més, també vaig fer dues entrevistes a experts en genètica i ètica.
Metodologia
Primer he realitzat una recerca teòrica sobre el tema per tenir els coneixements necessaris per fer la pràctica experimental. He utilitzat diverses pàgines webs d’internet, articles proporcionats pel professor Joan Blasi i el llibre de biologia de 1r i 2n de Batxillerat. En la part pràctica del treball he explicat les tècniques i la pràctica realitzada durant el mes de juliol i uns dies de setembre del 2018 i els resultats obtinguts. Tot seguit he inclòs un apartat centrat en CRISPR-CAS9, que és una nova eina que s’utilitza en l’enginyeria genètica, i sobre l’ús ètic d’aquesta tècnica. Per acabar, es troben les conclusions i la bibliografia.
Marc teòric
En aquest punt he desenvolupat quatre temes que serveixen per entendre el treball: l’enginyeria genètica, CRISPR-CAS9, toxina Èpsilon i la proteïna MAL.
Materials i tècniques
En aquest apartat he consignat les tècniques i els materials que vaig fer servir durant l’experiment.
Els materials més importants als que he fet referència són: cèl·lules JEKO-1, cèl·lules A549, proteïna GFP, màquina d’electroporació, microscopi Confocal i màquina Cell Sorter. Respecte a les tècniques he explicat: la tècnica de la Lipofectamina, l’electroporació, el Western Blot i la citometria de flux.
Experiment
 En aquest punt he desenvolupat pas a pas la pràctica feta al laboratori. L’experiment es va basar en fer una transfecció cel·lular per introduir dins de les cèl·lules un plasmidi que conté la informació per una proteïna específica, el MAL. Nosaltres el que volíem saber era si el MAL era el receptor de la toxina Èpsilon. En cas afirmatiu, quan s’ajunten poden matar a la cèl·lula i provocar greus problemes a l’ésser. Vam treballar amb dos tipus de cèl·lules, les JEKO-1 que són limfòcits B i les cèl·lules A549 que són cèl·lules epitelials del pulmó. Les JEKO-1 es van triar perquè se sap que la toxina afecta als limfòcits i les A549 per tenir dos models diferents de cèl·lules i comprovar que l’efecte no depèn solament d’un tipus cel·lular. Després de la transfecció, vam fer una prova de citotoxicitat exposant les cèl·lules a la toxina Èpsilon per comprovar si la toxina, en entrar en contacte amb una cèl·lula amb MAL, provocava o no la seva inactivació.
En aquest punt he desenvolupat pas a pas la pràctica feta al laboratori. L’experiment es va basar en fer una transfecció cel·lular per introduir dins de les cèl·lules un plasmidi que conté la informació per una proteïna específica, el MAL. Nosaltres el que volíem saber era si el MAL era el receptor de la toxina Èpsilon. En cas afirmatiu, quan s’ajunten poden matar a la cèl·lula i provocar greus problemes a l’ésser. Vam treballar amb dos tipus de cèl·lules, les JEKO-1 que són limfòcits B i les cèl·lules A549 que són cèl·lules epitelials del pulmó. Les JEKO-1 es van triar perquè se sap que la toxina afecta als limfòcits i les A549 per tenir dos models diferents de cèl·lules i comprovar que l’efecte no depèn solament d’un tipus cel·lular. Després de la transfecció, vam fer una prova de citotoxicitat exposant les cèl·lules a la toxina Èpsilon per comprovar si la toxina, en entrar en contacte amb una cèl·lula amb MAL, provocava o no la seva inactivació.
La variable independent de la pràctica va ser el diferent tipus de cèl·lula amb la proteïna MAL; la variable dependent la inactivació de la cèl·lula en presència de la toxina i la variable control, la cèl·lula amb només la proteïna GFP.
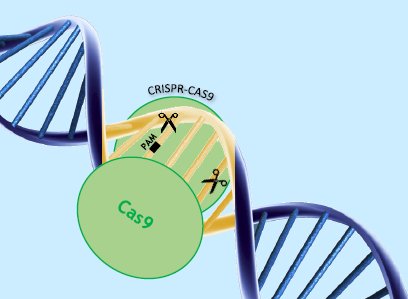
El CRISPR-CAS9: una nova eina d’edició genètica pel futur
En aquest apartat he exposat el CRISPR-CAS9 com una nova eina d’edició genètica. Mitjançant dues entrevistes fetes al Doctor Joan Blasi i a la Doctora Begoña Aran he mostrat els avantatges i inconvenients d’aquesta tècnica, l’ús que ha tingut fins ara i possibles usos que pot tenir en el futur. També he detallat quina importància pot tenir en el futur comparant-la amb les tècniques actuals i, finalment, els problemes ètics que pot generar.
Conclusions
En aquest últim punt del treball presento les conclusions finals a les quals he arribat. Gràcies a la opinió del dos experts entrevistats puc confirmar la primera hipótesi. El CRISPR té un gran nombre d’avantatges respecte a les tècniques actuals ja que és més precisa perquè permet tallar les seqüències d’ADN per llocs específics, és més econòmica i més fàcil d’utilitzar. Tot i això, de moment, també té inconvenients com, per exemple, el fet que la nucleasa, que talla l’ADN, pot tallar una seqüència incorrecta i crear un problema per l’ésser, o també pot ser que el sistema de reparació de les cèl·lules sigui complicat, que no es repari correctament i creï una mutació. Per tant, encara cal molta investigació.
 La segona hipòtesi plantejava que els dos tipus de cèl·lules incorporarien el gen de la proteïna MAL i l’expressarien. Efectivament tant les cèl·lules JEKO-1, com les A549 es van transfectar amb èxit amb les dues tècniques utilitzades, l’Electroporació i la Lipofectamina. Al cap d’uns dies de la transfecció vàrem observar que les A549 expressaven millor la proteïna i les JEKO-1 no tant. Després, al posar l’antibiòtic Geneticina vam fer una selecció només d’aquelles cèl·lules que havien incorporat la proteïna MAL. Finalment, les cèl·lules JEKO-1 les vam passar per el Cell Sorter per tenir una selecció només d’aquelles cèl·lules que millor expressaven la proteïna.
La segona hipòtesi plantejava que els dos tipus de cèl·lules incorporarien el gen de la proteïna MAL i l’expressarien. Efectivament tant les cèl·lules JEKO-1, com les A549 es van transfectar amb èxit amb les dues tècniques utilitzades, l’Electroporació i la Lipofectamina. Al cap d’uns dies de la transfecció vàrem observar que les A549 expressaven millor la proteïna i les JEKO-1 no tant. Després, al posar l’antibiòtic Geneticina vam fer una selecció només d’aquelles cèl·lules que havien incorporat la proteïna MAL. Finalment, les cèl·lules JEKO-1 les vam passar per el Cell Sorter per tenir una selecció només d’aquelles cèl·lules que millor expressaven la proteïna.
En canvi, en el cas de les cèl·lules A549 no els hi vam fer la citometria (passar pel Cell Sorter) perquè com són cèl·lules que estan enganxades a placa és molt difícil aplicar aquesta tècnica. De manera que després quan vam fer la prova de citotoxicitat, moltes d’aquestes cèl·lules havien perdut l’expressió de la proteïna perquè al anar-se dividint cada cop l’expressen menys.
Un cop vàrem tenir confirmada la segona hipòtesi vam utilitzar una sèrie de tècniques per afirmar o refutar la tercera. Necessitàvem saber si el MAL era l’acceptor de la toxina Èpsilon. El MAL s’expressa en la membrana dels oligodendròcits, la mielina i els limfòcits, en el nostre cas vam utilitzar les cèl·lules JEKO-1 que són limfòcits B. Gràcies a experiments previs sabem que la toxina s’uneix a la mielina, als oligodendròcits i volíem confirmar que també s’unia als limfòcits per després confirmar que el MAL és el possible receptor de la toxina. Els resultats de la prova de citotoxicitat van donar positiu amb les cèl·lules JEKO-1 el que ens permet afirmar que la toxina s’uneix també als limfòcits i, per tant, el seu receptor és molt possible que sigui proteïna MAL.
Per altra banda, les A549 són cèl·lules epitelials del pulmó i s’ha vist amb diferents experiments previs que la Etx també afecta al pulmó, així que era un bon model d’estudi. Però en aquestes, la prova de citotoxicitat va donar negatiu, o sigui que es pot dir que el receptor de la toxina, en aquest cas, no és el MAL. Amb els resultats obtinguts hem observat que quan les cèl·lules amb la proteïna MAL s’exposen a la toxina, proliferen més, de manera que no moren i sobreviuen. És molt possible que aquests resultats no siguin correctes ja que com que a aquestes cèl·lules no se’ls va fer la citometria, no es va poder fer una selecció de les cèl·lules que millor expressaven la proteïna, i és molt possible que al llarg del temps anessin perdent la fluorescència de forma que es van autosel·leccionar cèl·lules que no presentaven la proteïna MAL-GFP. A més a més, gràcies al Western Blot hem pogut veure que les cèl·lules a les quals se’ls va fer la prova de citotoxicitat, en el cas de les A549, no presentaven la proteïna.
De tota manera, per poder comprovar que realment la toxina ajuda la supervivència de les cèl·lules A549 amb el MAL s’haurien de fer més experiments i proves però, per manca de temps, no hem pogut seguir amb la investigació.
Finalment, valoro molt positivament la realització d’aquest treball ja que he après moltes coses noves que desconeixia que existien i es tracta d’un tema interessant al qual potser podria dedicar-me en el futur.



Comentaris recents